
具有治疗潜力的大麻二酚疗法EHP-101的安全性在早期试验中得到验证,作用于硬皮病患者的临床试验即将开展。
在2019年8月28获得的最新资讯中我们得知:EHP-101, 一种口服大麻二酚治疗硬皮病(SSc)和多发性硬化症(MS)的候选药物, 在由健康志愿者参与的一期临床试验中被发现具有良好的安全性和耐受性。
在2019年8月28获得的最新资讯中我们得知:EHP-101,一种口服大麻二酚治疗硬皮病(SSc)和多发性硬化症(MS)的候选药物,在由健康志愿者参与的一期临床试验中被发现具有良好的安全性和耐受性。
这些结果为目前正处于规划阶段的第二期临床试验扫清了道路,二期试验将测试EHP-101在SSc和MS患者中的安全性和有效性。 Emerald Health 制药公司(研发EHP-101的公司)在新闻发布会上宣布,第二期临床试验研究将于今年开始。
EHP-101的活性成分是:VCE-004.8 , 一种从大麻植物中提取的大麻二酚(CBD)的合成衍生物。
VCE-004.8能激活两种分别叫做PPARgamma和CB2的受体,这两种受体被认为参与了包括炎症在内的细胞机制。
采用随机、双盲实验方法的第1期临床试验(试验注册号:ACTRN12618001390279p)评估了增加候选药物
(即:EHP-101)剂量的安全性和药理作用概况,并且探究了104名参加试验的澳大利亚健康志愿者体内的生物标志物。
(此处“药理作用概况”即:药物动力学,是指定量研究药物在生物体内吸收、分布、代谢和排泄规律,并运用数学原理和方法阐述血药浓度随时间变化的规律的学科)
在单次增加剂量的试验部分,受试者被分为8组,随机的给予安慰剂或者EPH-101,剂量从0.9mg到185mg不等。 在多次增加剂量的试验部分,受试者被分成4组,每天1次或2次给予安慰剂或EHP-101,持续7天,每天增加的剂量范围为20mg(低剂量组)到100mg(高剂量组)。 所有剂量的EHP-101均在受试者中体现出良好的耐受性,随着剂量的增加,仅观察到轻度至中度的副作用。 Emerald公司表示,这项实验中使用的最高剂量远高于预期用于治疗硬皮病和多发性硬化症的剂量。
“EHP-101在我们大规模的首次人体实验中表现出来的安全性和耐受性使我们能够确定合适的给药方案,
并继续进行我们计划的第二期临床试验研究“ Joachim Schupp(医学博士,Emerald健康公司首席医学官)在发布会上说到。
“我代表我们整个EHP-101研究团队,”Schupp博士补充道,“感谢研究人员、受试志愿者和研究团队的所有成员, 在我们努力为那些治疗需求未得到满足的患者研发新疗法的过程中,为理解EHP-101在人体中的作用做出的贡献。” 在临床前工作中, EHP-101在硬皮病小鼠模型中表现出了抗炎和抗纤维化(疤痕形成),以及减轻皮肤厚度和修复受损血管的作用。
Emerald健康公司首席执行官Jim DeMesa博士表示,这些结果,连同临床前的发现和其他工作,
使Emerald能很好的进行定位“通过临床开发推动我们的候选疗法(EHP-101)面世”。
EHP-101分别在2017和2018年先后被美国食品和药物管理局(FDA)以及欧洲药物管理局(EMA)认定为孤儿药。
美国药品强制管理局(也称美国禁毒署--U.S. Drug Enforcement Administration)最近批准了VCE-004.8的使用,
确定其不属于《管制物质法令》(The controlled Substances Act)规定的受控物质。
VCE-004.8是EHP-101疗法的有效成分,因此VCE-004.8不像迷幻剂、麻醉剂、镇静剂和兴奋剂那样被定义为可能与滥用有关的物质。
文章来源:Scleroderma News
原文网址: https://sclerodermanews.com/2019/08/28/ehp-101-found-safe-in-early-trial-phase-2-scleroderma-study-being-readied/?utm_source=Scleroderma&utm_campaign=01ba5c63c2-RSS_MONDAY_EMAIL_CAMPAIGN&utm_medium=email&utm_term=0_8741067e1d-01ba5c63c2-72033493
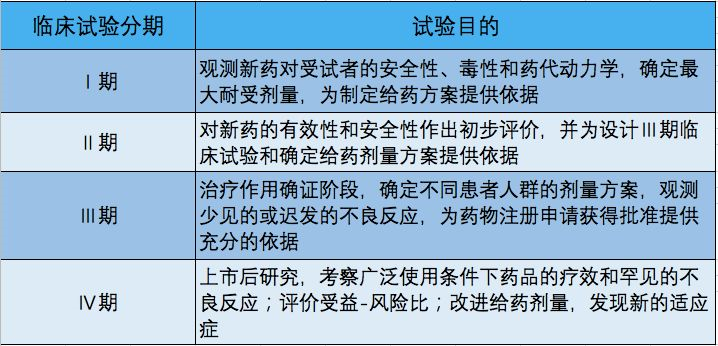
知识拓展:药物研发路线简介
基础研究:致力于研究生物如何运作,但是并不与任何有关疾病的运用有必然联系。
转化型研究:被描述为”临床实践”研究,或者将基础研究中研究成果应用于研发一些特定疾病及障碍的药物。
从基础研究到临床前研究这一步需要大量的资源,这些资源其中许多是非常昂贵的,
而且无法找到足够安全高效的药物进入临床阶段研究的风险是很高的。
因为这些挑战从而导致了我们所说的“转化研究鸿沟”。
临床前研究:定义一个特定的疗效和在开始人类临床试验前测试它的安全性以及有效性。
临床研究:通过测试治疗,诊断,预防某种疾病或者为某种疾病提供支持性照顾的方法,确保他们安全有效。
上市后研究:为了长期性的安全问题以及关于益处、临床使用的附加信息而测验疗法。
翻译整理/程晓波
内容校对、图文整理/郑嫒
编辑排版/瑶瑶
